สมดุลเคมี
1 ความหมายของสมดุลเคมี
ในเรื่องปฏิกิริยาเคมี สมดุลเคมี (อังกฤษ: Chemical equilibrium) คือสภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป เราจะเรียกว่าปฏิกิริยาเคมีนั้นอยู่ในสมดุล (equilibrium) ทั้งนี้ การดำเนินไปของปฏิริยาไม่ได้สิ้นสุดลงแต่ระบบยังคงมีการเปลี่ยนแปลงอยู่ตลอดเวลา เรียกว่า สมดุลไดนามิก (dynamic equilibrium)
2. การศึกษาสมดุลเคมี
แนวคิดเกี่ยวกับสมดุลเคมี ได้เริ่มพัฒนาขึ้นหลังจากการศึกษาของ โคล้ด หลุยส์ แบร์โธเล่ต์ (Claude Louis Berthollet) นักเคมีชาวฝรั่งเศส ที่พบว่าปฏิกิริยาเคมีบางชนิดเป็นปฏิกิริยาผันกลับได้ (reversible reaction) โดยในสมดุลเคมีนั้น อัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction) จะเท่ากับอัตราการเกิดปฏิกิริยาย้อน กลับ (backward หรือ reverse reaction) สมการต่อไปนี้ เป็นการแสดงสมดุลเคมีของปฏิกิริยาระหว่างสาร A และ สาร B เกิดเป็นสาร S และ สาร T โดยที่ α, β, σ และ τ เป็นสัมประสิทธิ์ปริมาณสัมพันธ์ (stoichiometric coefficient) ของปฏิกิริยาดังกล่าว
สมดุลเคมี คือ สภาวะสมดุลที่เกิดขึ้นเมื่อระบบเข้าสู่สภาวะคงที่ แต่ยังคงมีการดำเนินต่อไปเรื่อยๆด้วยอัตราเร็วของปฏิกิริยาเคมีนั้นๆ ซึ่งค่าของอัตราการเกิดปฏิกิริยาไปข้างหน้าจะเท่ากับค่าของอัตราการเกิดปฏิกิริยาย้อนกลับ โดยสมบัติของปฏิกิริยานี้จะไม่มีการเปลี่ยนแปลงแม้เวลาจะผ่านไปนานเท่าไรก็ตาม สามารถเรียกภาวะสมดุลนี้ได้ว่า ภาวะสมดุลไดนามิก
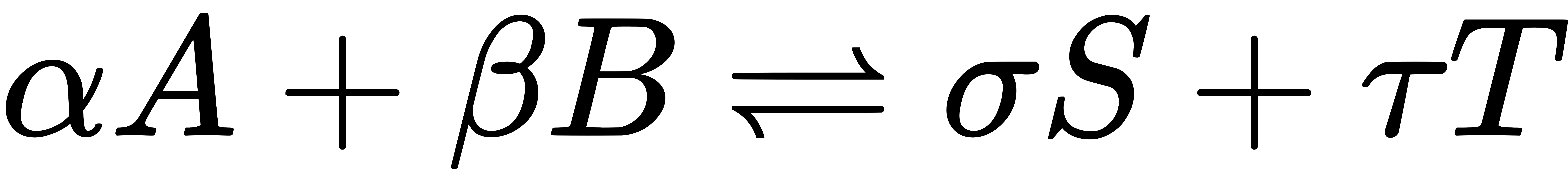
ถ้าหากปฏิกิริยาเกิดไปข้างหน้าได้มากๆ ความเข้มข้นของสารตั้งต้น A แฃะสาร B เหลือน้อยมากๆ อาจจะกล่าวอีกนัยหนึ่ง คือ มี สมบูรณ์ของปฏิกิริยา (reaction completeness) สูง หรือถ้าปฏิกิริยาย้อนกลับเกิดได้ดีมากๆทำให้ความเข้มข้นของสาร A และสาร B สูงในขณะที่ความเข้มข้นของสาร S และ T น้อยมาก อาจกล่าวได้ว่าปฏิกิริยาเกิดได้ไม่สมบูรณ์ ดังนั้น การอธิบายปฏิกิริยาเคมีในสมดุลจึงสามารถบอกความสมบูรณ์ของปฏิกิริยาได้ ซึ่งการคำนวณจะเกี่ยวข้องกับ ค่าคงที่สมดุลเคมี (chemical equilibrium:K)
3. คุณสมบัติของสมดุลเคมี
1. สมดุลเคมีจะต้องเกิดในระบบปิดเท่านั้น 2. สมดุลจะต้องเกิดการเปลี่ยนแปลงที่ผผันกลับได้ 3. ค่าอัตราการเกิดของปฏิกิริยาไปข้างหน้าจะเท่ากับค่าอัตราการเกิดปฏิกิริยาไปข้างหลัง 4. ในทุกๆ ระบบจะมีสารตั้งต้นเหลืออยู่ 5. ค่าของระบบนั้นๆจะคงที่
การเกิดปฏิกิริยา
การเกิดปฏิกิริยา คือการเกิดการเปลี่ยนแปลงโดยทั่วไปโดยส่วนใหญ่การเปลี่ยนแปลง มักจะเป็นปฏิกิริยาของสารเคมี สามารถแบ่งออกได้เป็น 2 ประเภท คือ 1.ปฏิกิริยาที่เกิดขึ้นสมบูรณ์ ปฏิกิริยาที่เกิดขึ้นสมบูรณ์ คือ ปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันจนหมดและเกิดเป็นสารผลิตภัณฑ์ ปฏิกิริยาที่เกิดขึ้นสมบูรณ์จะยุติลงเมื่อสารตั้งต้นตัวใดตัวหนึ่งหมดและปฏิกิริยาจะไม่สามารถกลับไปเป็นสารตั้งต้นได้อีก
2.ปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์ ปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์คือปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันจนได้ผลิตภัณฑ์และในขณะเดียวกันสารตั้งต้นบางส่วนและบางชนิดสารกลับไปเป็นสารตั้งต้นใหม่ได้ ทำให้สารตั้งต้นในปฏิกิริยาเหลือทุกชนิดไม่ว่าเวลาจะผ่านไปนานเท่าไหร่ก็ตาม ระบบของปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์จึงมีทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ
4. การเปลี่ยนแปลงที่ผันกลับได้
การเปลี่ยนแปลงที่ผันกลับได้มีทั้งแบบที่เป็นระบบปฏิกิริยาและไม่เป็นระบบปฏิกิริยา การเปลี่ยนแปลงที่ผันกลับได้สามารถแบ่งออกได้เป็น 3 ประเภท 1. การละลายเป็นสารละลาย คือ การเปลี่ยนสถานะของแข็งโดยการละลายจากของแข็งเป็นของเหลว จากของเหลวเป็นก๊าซ 2. การเปลี่ยนสถานะของสาร คือ การเปลี่ยนสถานะให้ของแข็ง ของเหลว ก๊าซ ได้โดยอาศัยการดูดความร้อน และการคายความร้อนเข้ามาเกี่ยวข้อง 3. การเกิดปฏิกิริยาเคมี คือ การเปลี่ยนแปลงที่ทำให้เกิดสารใหม่ที่มีคุณสมบัติที่แตกต่างไปจากสารเดิม สารที่เป็นได้ทั้งปฏิกิริยาที่เกิดขึ้นสมบูรณ์ และปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์
5. ค่าคงที่สมดุล
ในปฏิกิริยาเคมีที่ผันกลับได้ทั่วๆไปต่อไปนี้
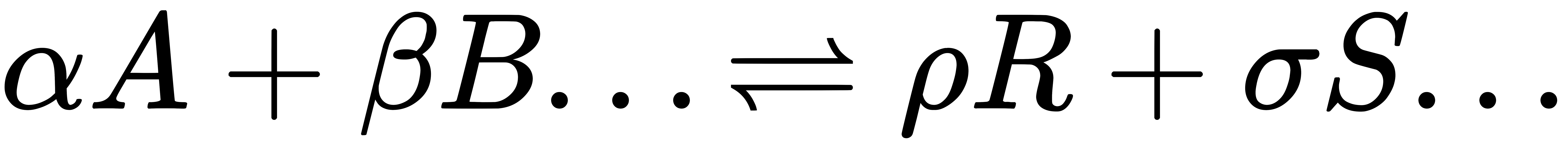
ค่าคงที่สมดุลไดนามิกส์ ถูกนิยามขึ้น โดย สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC ) ดังนี้
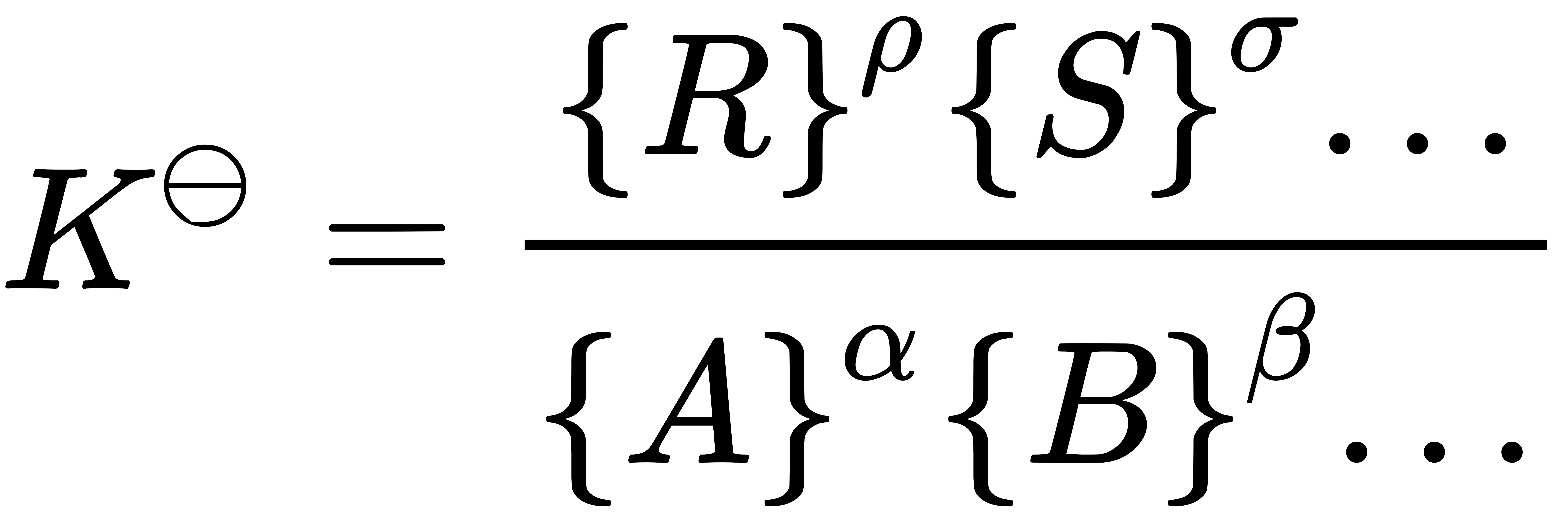
เมื่อ {A} คือ แอกทิวิตี (activity)ของสาร A, {B} คือ แอกทิวิตีของสาร B, ... ทั้งนี้ การแสดงความสัมพันธ์ข้างต้น เป็นการพิจารณาการเปลี่ยนแปลงพลังงานอิสระกิ๊บส์ (Gibbs free energy) แต่ในทางปฏิบัติแล้ว เรานิยมใช้ความเข้มข้นของสาร อาทิ [A], [B], ... มากกว่าการใช้แอกทิวิตี และใช้ ผลหารความเข้มข้น (concentration quotient, Kc) มากกว่า ดังสมการ
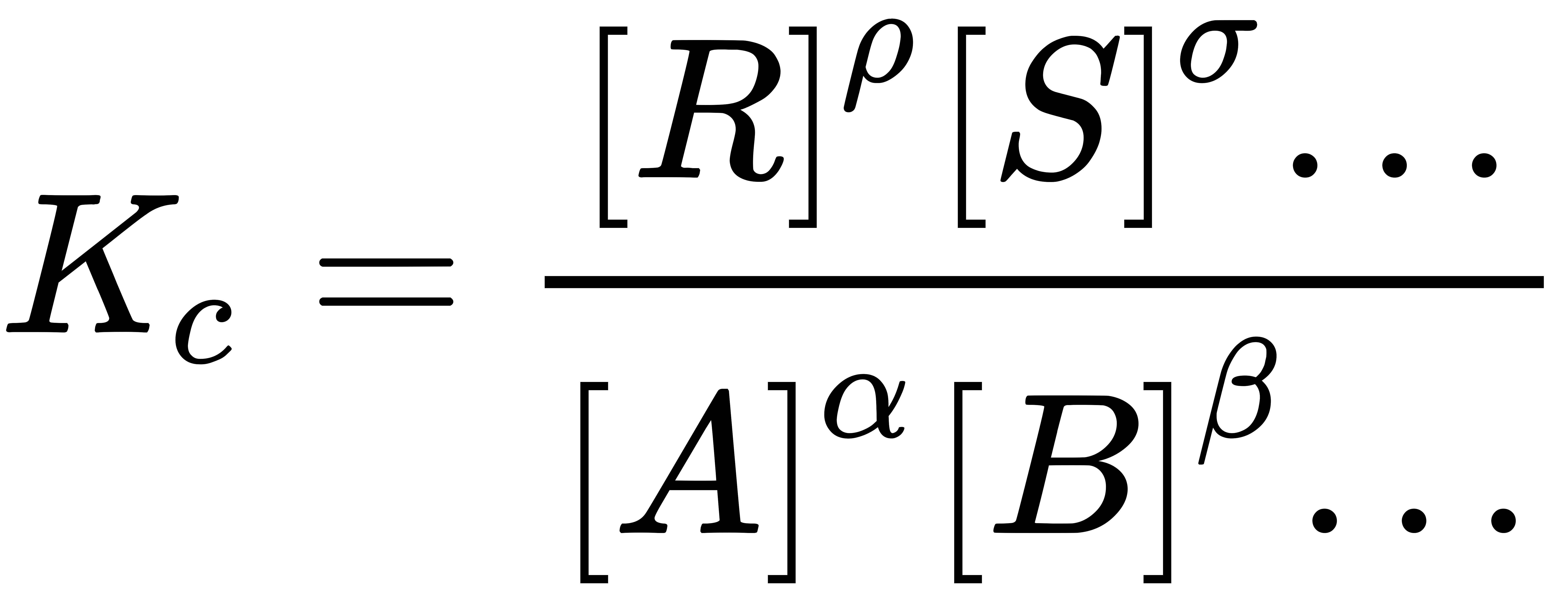
เมื่อ Kc เท่ากับค่าคงที่สมดุลทางเทอร์โมไดนามิกส์ หารด้วย ผลหารสัมประสิทธิ์แอกทิวิตี (quotient of activity coefficients) เมื่อมีค่าเท่ากับ 1 จะได้ว่า Kc = Kc
6. ตัวอย่างสมดุลเคมีที่สำคัญ
สมดุลกรด-เบส
ปฏิกิริยากรด-เบสของกรดอ่อนหรือเบสอ่อนซึ่งเป็นปฏิกิริยาผันกลับได้นั้น การพิจารณาการแตกตัวของกรดอ่อนหรือเบสอ่อนมีความสำคัญมาก โดยค่าคงที่สมดุลของปฏิกิริยาการแตกตัวของกรดจะเรียกว่า ค่าคงที่การแตกตัวของกรด (acid dissociation constant, Ka)
HA ⇌ A− + H+
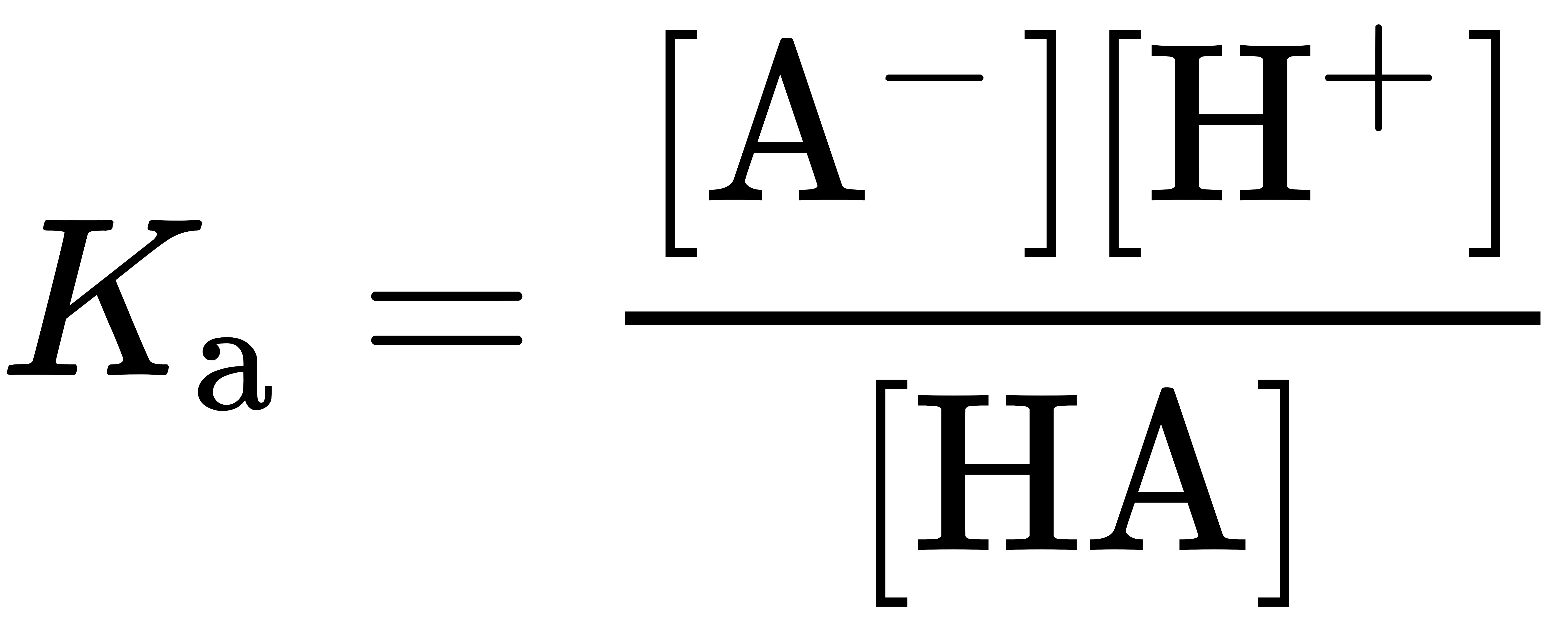
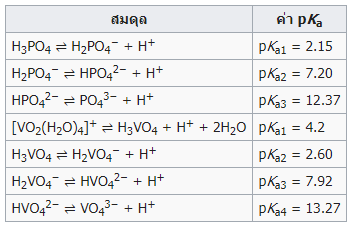
โดยความหมายในทางเคมีของค่าคงที่นี้บ่งบอกความสมบูรณ์ของการแตกตัวของกรด หรือบอกความแรงของกรดนั่นเอง ซึ่งปกติแล้วค่าคงที่การแตกตัวของกรดมีค่าน้อยมาก จึงนิยมแสดงในรูปของค่า pKa ซึ่งกำหนดให้เท่ากับ -log (Ka) ตารางต่อไปนี้แสดงตัวอย่างของค่าคงที่การแตกตัวของกรดอ่อนบางชนิด
สมดุลการละลาย
การละลายของสารประกอบไอออนิกในน้ำได้น้อยแล้วเกิดการแตกตัวเป็นไอออน จะอยู่ในสมดุลเคมีของการละลาย เช่น การละลายน้ำของเกลือแคลเซียมซัลเฟต ดังสมการต่อไปนี้
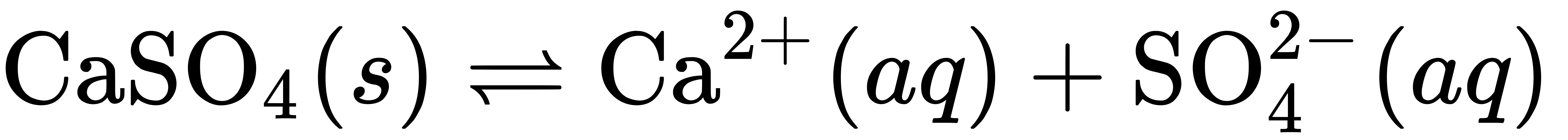
ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ของแคลเซียมซัลเฟตจะเป็น ดังนี้
เมื่อ KStrikeO.png ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ และคำนวณโดยใช้ค่าแอกทิวิตีของไอออนต่างๆในระบบ อย่างไรก็ตาม ของแข็งมีค่าแอกทิวิตีเท่ากับ 1 และเมื่อเราพิจารณาโดยใช้ความเข้มข้นของไอออนค่าคงที่จะเรียกว่า ค่าคงที่ผลคูณไอออน (ionic solubility product: Ksp)
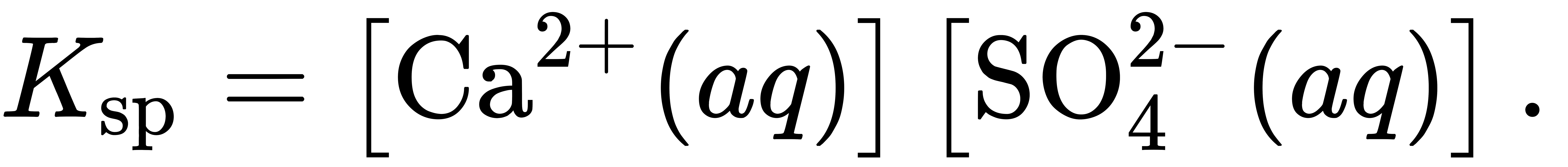
อ้างอิง : Wikipedia : สมดุลเคมี
ในเรื่องปฏิกิริยาเคมี สมดุลเคมี (อังกฤษ: Chemical equilibrium) คือสภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป เราจะเรียกว่าปฏิกิริยาเคมีนั้นอยู่ในสมดุล (equilibrium) ทั้งนี้ การดำเนินไปของปฏิริยาไม่ได้สิ้นสุดลงแต่ระบบยังคงมีการเปลี่ยนแปลงอยู่ตลอดเวลา เรียกว่า สมดุลไดนามิก (dynamic equilibrium)
2. การศึกษาสมดุลเคมี
แนวคิดเกี่ยวกับสมดุลเคมี ได้เริ่มพัฒนาขึ้นหลังจากการศึกษาของ โคล้ด หลุยส์ แบร์โธเล่ต์ (Claude Louis Berthollet) นักเคมีชาวฝรั่งเศส ที่พบว่าปฏิกิริยาเคมีบางชนิดเป็นปฏิกิริยาผันกลับได้ (reversible reaction) โดยในสมดุลเคมีนั้น อัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction) จะเท่ากับอัตราการเกิดปฏิกิริยาย้อน กลับ (backward หรือ reverse reaction) สมการต่อไปนี้ เป็นการแสดงสมดุลเคมีของปฏิกิริยาระหว่างสาร A และ สาร B เกิดเป็นสาร S และ สาร T โดยที่ α, β, σ และ τ เป็นสัมประสิทธิ์ปริมาณสัมพันธ์ (stoichiometric coefficient) ของปฏิกิริยาดังกล่าว
สมดุลเคมี คือ สภาวะสมดุลที่เกิดขึ้นเมื่อระบบเข้าสู่สภาวะคงที่ แต่ยังคงมีการดำเนินต่อไปเรื่อยๆด้วยอัตราเร็วของปฏิกิริยาเคมีนั้นๆ ซึ่งค่าของอัตราการเกิดปฏิกิริยาไปข้างหน้าจะเท่ากับค่าของอัตราการเกิดปฏิกิริยาย้อนกลับ โดยสมบัติของปฏิกิริยานี้จะไม่มีการเปลี่ยนแปลงแม้เวลาจะผ่านไปนานเท่าไรก็ตาม สามารถเรียกภาวะสมดุลนี้ได้ว่า ภาวะสมดุลไดนามิก
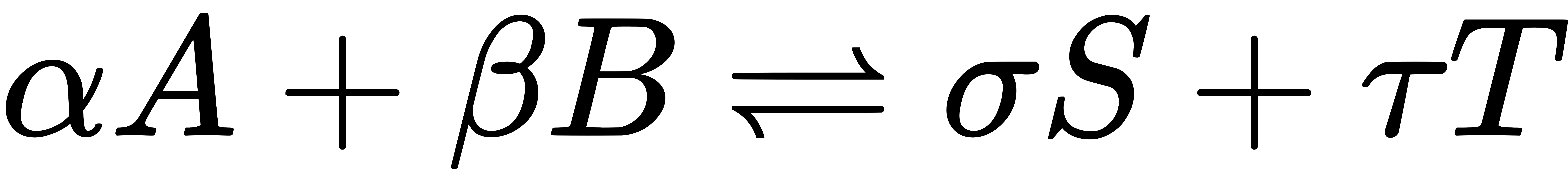
ถ้าหากปฏิกิริยาเกิดไปข้างหน้าได้มากๆ ความเข้มข้นของสารตั้งต้น A แฃะสาร B เหลือน้อยมากๆ อาจจะกล่าวอีกนัยหนึ่ง คือ มี สมบูรณ์ของปฏิกิริยา (reaction completeness) สูง หรือถ้าปฏิกิริยาย้อนกลับเกิดได้ดีมากๆทำให้ความเข้มข้นของสาร A และสาร B สูงในขณะที่ความเข้มข้นของสาร S และ T น้อยมาก อาจกล่าวได้ว่าปฏิกิริยาเกิดได้ไม่สมบูรณ์ ดังนั้น การอธิบายปฏิกิริยาเคมีในสมดุลจึงสามารถบอกความสมบูรณ์ของปฏิกิริยาได้ ซึ่งการคำนวณจะเกี่ยวข้องกับ ค่าคงที่สมดุลเคมี (chemical equilibrium:K)
3. คุณสมบัติของสมดุลเคมี
1. สมดุลเคมีจะต้องเกิดในระบบปิดเท่านั้น 2. สมดุลจะต้องเกิดการเปลี่ยนแปลงที่ผผันกลับได้ 3. ค่าอัตราการเกิดของปฏิกิริยาไปข้างหน้าจะเท่ากับค่าอัตราการเกิดปฏิกิริยาไปข้างหลัง 4. ในทุกๆ ระบบจะมีสารตั้งต้นเหลืออยู่ 5. ค่าของระบบนั้นๆจะคงที่
การเกิดปฏิกิริยา
การเกิดปฏิกิริยา คือการเกิดการเปลี่ยนแปลงโดยทั่วไปโดยส่วนใหญ่การเปลี่ยนแปลง มักจะเป็นปฏิกิริยาของสารเคมี สามารถแบ่งออกได้เป็น 2 ประเภท คือ 1.ปฏิกิริยาที่เกิดขึ้นสมบูรณ์ ปฏิกิริยาที่เกิดขึ้นสมบูรณ์ คือ ปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันจนหมดและเกิดเป็นสารผลิตภัณฑ์ ปฏิกิริยาที่เกิดขึ้นสมบูรณ์จะยุติลงเมื่อสารตั้งต้นตัวใดตัวหนึ่งหมดและปฏิกิริยาจะไม่สามารถกลับไปเป็นสารตั้งต้นได้อีก
2.ปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์ ปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์คือปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันจนได้ผลิตภัณฑ์และในขณะเดียวกันสารตั้งต้นบางส่วนและบางชนิดสารกลับไปเป็นสารตั้งต้นใหม่ได้ ทำให้สารตั้งต้นในปฏิกิริยาเหลือทุกชนิดไม่ว่าเวลาจะผ่านไปนานเท่าไหร่ก็ตาม ระบบของปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์จึงมีทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ
4. การเปลี่ยนแปลงที่ผันกลับได้
การเปลี่ยนแปลงที่ผันกลับได้มีทั้งแบบที่เป็นระบบปฏิกิริยาและไม่เป็นระบบปฏิกิริยา การเปลี่ยนแปลงที่ผันกลับได้สามารถแบ่งออกได้เป็น 3 ประเภท 1. การละลายเป็นสารละลาย คือ การเปลี่ยนสถานะของแข็งโดยการละลายจากของแข็งเป็นของเหลว จากของเหลวเป็นก๊าซ 2. การเปลี่ยนสถานะของสาร คือ การเปลี่ยนสถานะให้ของแข็ง ของเหลว ก๊าซ ได้โดยอาศัยการดูดความร้อน และการคายความร้อนเข้ามาเกี่ยวข้อง 3. การเกิดปฏิกิริยาเคมี คือ การเปลี่ยนแปลงที่ทำให้เกิดสารใหม่ที่มีคุณสมบัติที่แตกต่างไปจากสารเดิม สารที่เป็นได้ทั้งปฏิกิริยาที่เกิดขึ้นสมบูรณ์ และปฏิกิริยาที่เกิดขึ้นไม่สมบูรณ์
5. ค่าคงที่สมดุล
ในปฏิกิริยาเคมีที่ผันกลับได้ทั่วๆไปต่อไปนี้
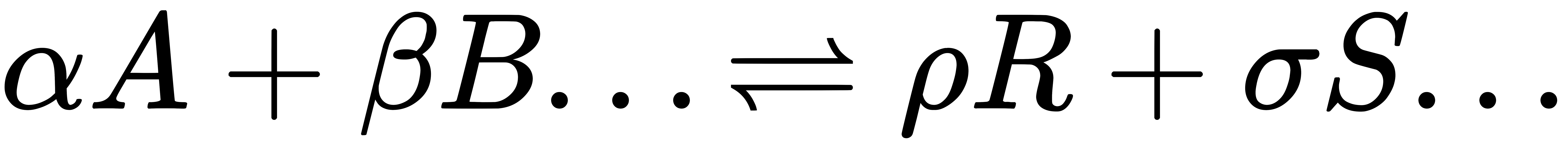
ค่าคงที่สมดุลไดนามิกส์ ถูกนิยามขึ้น โดย สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC ) ดังนี้
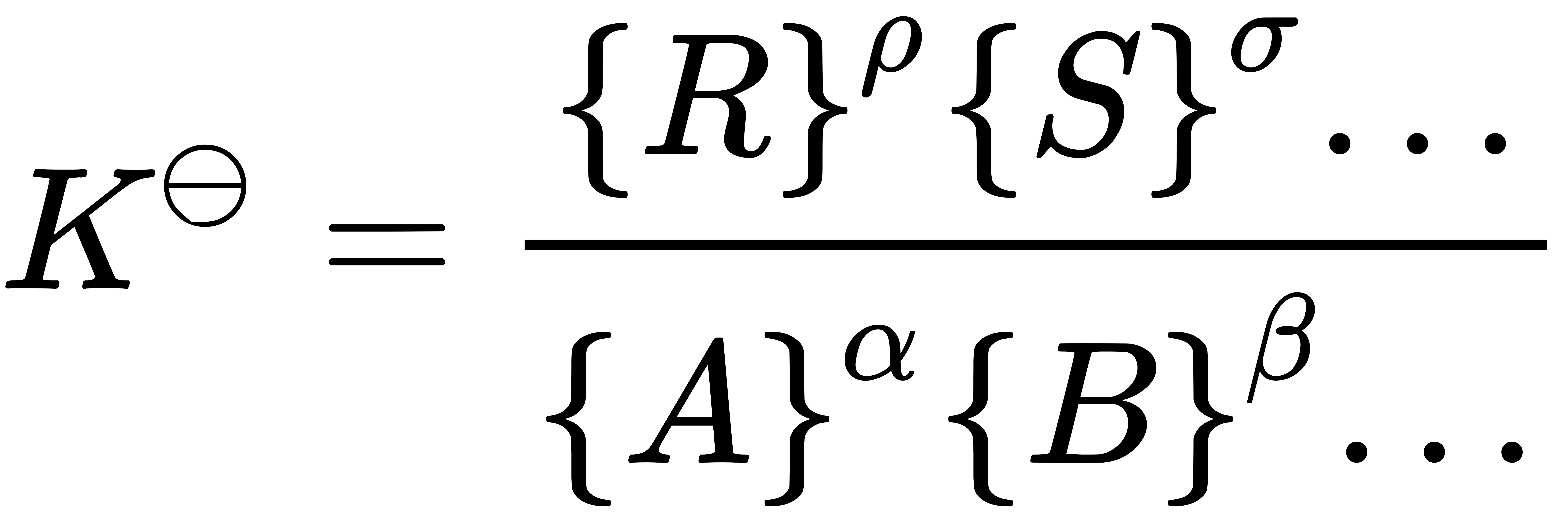
เมื่อ {A} คือ แอกทิวิตี (activity)ของสาร A, {B} คือ แอกทิวิตีของสาร B, ... ทั้งนี้ การแสดงความสัมพันธ์ข้างต้น เป็นการพิจารณาการเปลี่ยนแปลงพลังงานอิสระกิ๊บส์ (Gibbs free energy) แต่ในทางปฏิบัติแล้ว เรานิยมใช้ความเข้มข้นของสาร อาทิ [A], [B], ... มากกว่าการใช้แอกทิวิตี และใช้ ผลหารความเข้มข้น (concentration quotient, Kc) มากกว่า ดังสมการ
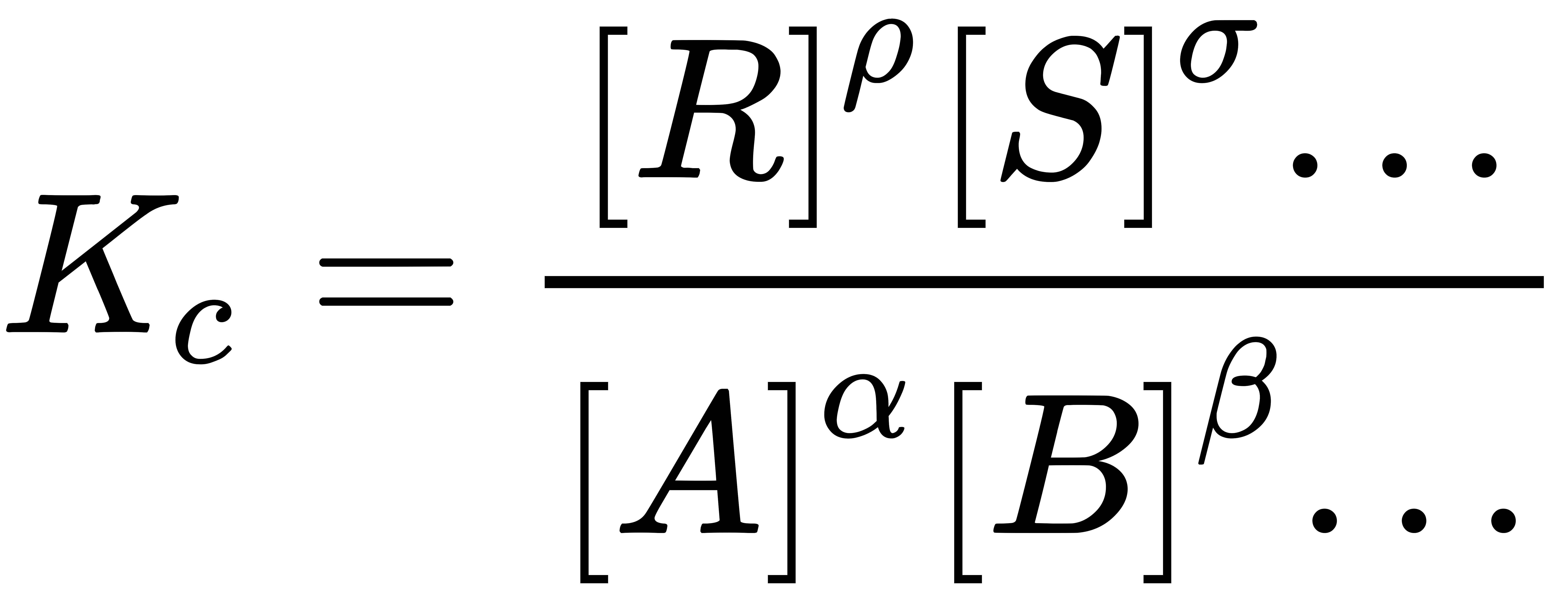
เมื่อ Kc เท่ากับค่าคงที่สมดุลทางเทอร์โมไดนามิกส์ หารด้วย ผลหารสัมประสิทธิ์แอกทิวิตี (quotient of activity coefficients) เมื่อมีค่าเท่ากับ 1 จะได้ว่า Kc = Kc
6. ตัวอย่างสมดุลเคมีที่สำคัญ
สมดุลกรด-เบส
ปฏิกิริยากรด-เบสของกรดอ่อนหรือเบสอ่อนซึ่งเป็นปฏิกิริยาผันกลับได้นั้น การพิจารณาการแตกตัวของกรดอ่อนหรือเบสอ่อนมีความสำคัญมาก โดยค่าคงที่สมดุลของปฏิกิริยาการแตกตัวของกรดจะเรียกว่า ค่าคงที่การแตกตัวของกรด (acid dissociation constant, Ka)
HA ⇌ A− + H+
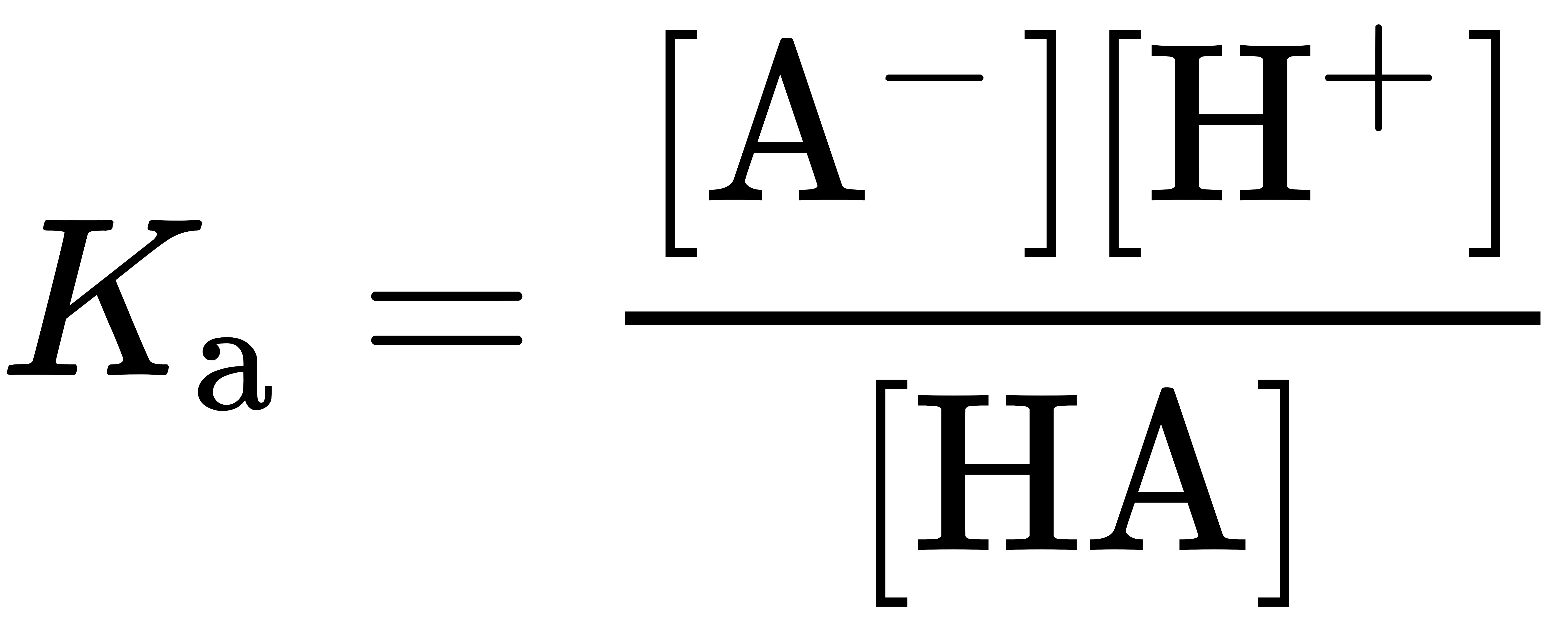
โดยความหมายในทางเคมีของค่าคงที่นี้บ่งบอกความสมบูรณ์ของการแตกตัวของกรด หรือบอกความแรงของกรดนั่นเอง ซึ่งปกติแล้วค่าคงที่การแตกตัวของกรดมีค่าน้อยมาก จึงนิยมแสดงในรูปของค่า pKa ซึ่งกำหนดให้เท่ากับ -log (Ka) ตารางต่อไปนี้แสดงตัวอย่างของค่าคงที่การแตกตัวของกรดอ่อนบางชนิด

สมดุลการละลาย
การละลายของสารประกอบไอออนิกในน้ำได้น้อยแล้วเกิดการแตกตัวเป็นไอออน จะอยู่ในสมดุลเคมีของการละลาย เช่น การละลายน้ำของเกลือแคลเซียมซัลเฟต ดังสมการต่อไปนี้
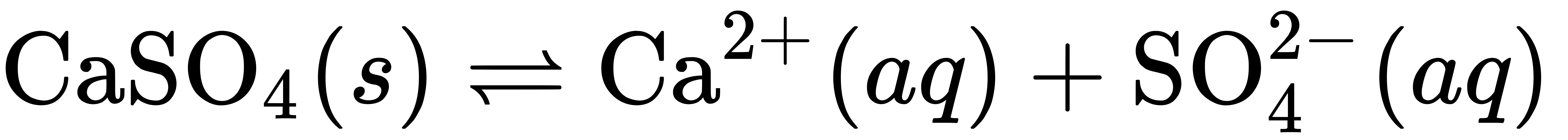
ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ของแคลเซียมซัลเฟตจะเป็น ดังนี้
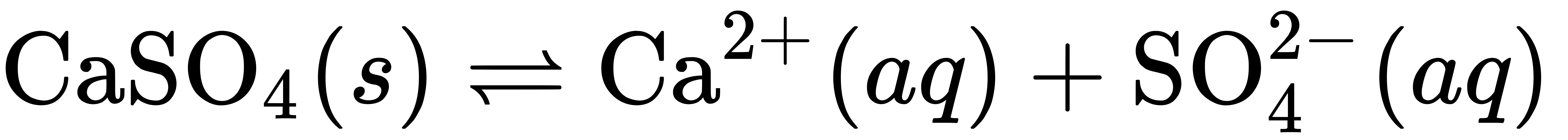
เมื่อ KStrikeO.png ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ และคำนวณโดยใช้ค่าแอกทิวิตีของไอออนต่างๆในระบบ อย่างไรก็ตาม ของแข็งมีค่าแอกทิวิตีเท่ากับ 1 และเมื่อเราพิจารณาโดยใช้ความเข้มข้นของไอออนค่าคงที่จะเรียกว่า ค่าคงที่ผลคูณไอออน (ionic solubility product: Ksp)
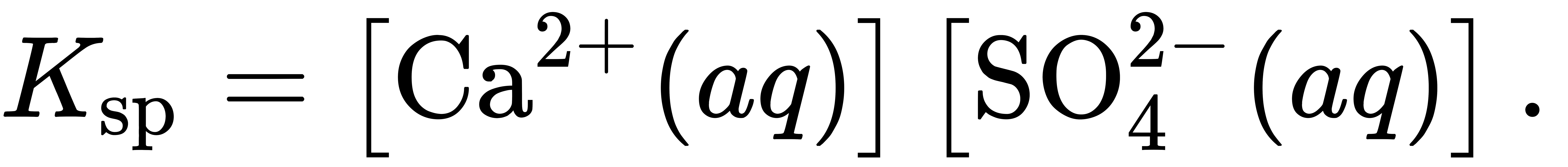
อ้างอิง : Wikipedia : สมดุลเคมี